血液ガス分析で目にするAnion Gap(AG)とBase Excess(BE)ですがどのような意味があるのでしょうか。
学生の時はなんとなくで済ませていた部分だったのでまとめてみました。
代謝性因子の鑑別
基本的にAGは代謝性アシドーシス、BEは代謝性アシドーシス/アルカローシスの存在を見分けるのに用いられます。
特に救急の現場で問題になるのは代謝性アシドーシスです。
末梢循環不全やショックの場合には乳酸アシドーシスになりますし、その他糖尿病性ケトアシドーシスなども見逃してはならない重要な疾患です。
※ちなみに重症代謝性アシドーシスに用いられる薬剤がメイロン®です。国試ではメニエール病の治療薬として有名ですが、組成がNaHCO3なので重炭酸の補充ができる重要な薬剤です。
それではAGとBEそれぞれの意義について詳しく述べていきます。
Anion Gapとは
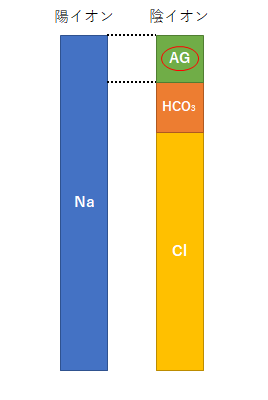
人体の血液中には陽イオンと陰イオンがあり、その総量は同じということが知られています(電気的中性)。
陽イオンのほとんどを占めるのがNaイオンであり、陰イオンの大半はClイオンとHCO3イオン(重炭酸イオン)です。
そして電気的中性を埋めている測定されない陰イオンがAnion Gap(AG)と呼ばれており、
AG=Na-(Cl+HCO3)
で求めることができます。(右図参照)
※陽イオンにはこの他Kイオン、Caイオン、Mgイオンなどがありますが、Naイオンに比べるとかなり濃度が少ないのでここでは無視しています。
AGの中には乳酸イオンやケト酸(ケトン体)、硫酸イオンなどがあり、臨床的にはAGの上昇(開大)が非常に問題になります。
AGが上昇する病態とはこれら(不揮発酸と呼ばれます)の増加を意味します。すなわち、
乳酸の増加→乳酸アシドーシス(敗血症、末梢循環不全など)
ケト酸の増加→糖尿病性ケトアシドーシス、アルコール性ケトアシドーシスなど
硫酸など(本来は腎臓から排泄される酸)の増加→腎不全
などが挙げられます。
いずれも酸が増加する病態なのでAGの上昇(開大)は代謝性アシドーシスの存在を示唆します。
AGの欠点
実はAGの大半を占めているのがアルブミンです。
アルブミンは血中で陰イオンとして存在しており、低アルブミン血症ではAGが見かけより低くなるという現象が起こります。
そのため低アルブミン血症の時は補正AGというものを用います。
補正AG=AG測定値+{(アルブミン基準値)-(アルブミン測定値)}
で求められます。アルブミン基準値は4.0が一般的と思います。
低アルブミン血症の場合に補正AGを求めないとAG開大性の代謝性アシドーシスが起こっていてもAG測定値は基準範囲内ということがおこりうるので注意が必要です。
Base Excessとは
Base Excessは直訳すると「塩基過剰」であり、「体温37℃ , PaCO2が40Torrの時に血液をpH7.40に戻すために必要な酸の量」と定義されています。
ややこしい言い回しですが、簡単に言うと
BEが正の数→塩基が多い、つまりアルカレミア
BEが負の数 →塩基が少ない、つまりアシデミア
と考えれば問題ないです。BEの基準値は0±2(測定機によって若干差はあります)です。
基本的にはBEとHCO3は同じ動きをするので、
BEが低下=HCO3低下で、BEが上昇=HCO3上昇となります。
BEは「体温37℃ , PaCO2が40Torrの時」という前提があるので、HCO3と異なり呼吸状態に影響を受けずに塩基量を評価することができます*。
つまり、BEは純粋な代謝性因子を評価するのに役立ちます。従って
BEが正の数→代謝性アルカローシスまたは呼吸性アシドーシスの代謝性代償
BEが負の数→代謝性アシドーシスまたは呼吸性アルカローシスの代謝性代償
と言えます。
救急の現場では代謝性アシドーシスが問題となると先程も述べましたが、pHが下がっていてBEも下がっていれば代謝性アシドーシスが存在していると言えるのです。
しかしながら呼吸性因子を排除しているために複数の酸塩基平衡障害を合併している場合などでは使いにくく、BEだけでは判断は難しいのも事実です。
BEを用いる場合でもHCO3を見ることは必須と言えます。
実際BEをほとんど使わない先生も結構いますし、HCO3で事足りることが多いです。
メリットはあまりないように見えますが、基準値が0であることと+か-かでアシドーシス/アルカローシスを判定できるのが視覚的にわかりやすいという理由で私は結構BEを使っています(勿論HCO3のチェックもしていますが)。
ここから先は少しややこしいので読み飛ばしても大丈夫です。
*の部分で「HCO3は純粋な代謝性因子を反映しないのか?」と疑問を持った人向けです。
酸塩基平衡を考えるうえで非常に重要なHenderson-Hasselbalchの式というものがあります。
pH = 6.1 + log{ [HCO3] / 0.03 × PaCO2}
この式は「pHをCO2とHCO3から求めることができる」ことを意味しており、これを利用することで
PaCO2上昇/低下→pHは低下/上昇
HCO3上昇/低下→pHは上昇/低下
と言えるのです。
しかしながらこの式の前提になっているのが
CO2 + H2O ⇄ H2CO3 ⇄ H⁺ + HCO3⁻
という緩衝式で、この式によるとCO2が上昇するとHCO3⁻は上昇し、CO2が低下するとHCO3⁻は低下すると言えます(これは代謝性代償とは少し違います)。
つまりCO2とHCO3は互いに独立した因子ではなく、それぞれの影響を少なからず受けるのでHCO3の変化は必ずしも純粋な代謝性変化とは言えないのです。
Twitter:@yutoridesuga113
フォローお願いします!


コメント